Governo gasta R$ 208 milhões em testes para Covid-19 que não têm registro na Anvisa
Saúde
'Biomol Onestep', exame do tipo RT-PCR produzido no Paraná, foi enviado ao Ministério da Saúde e distribuído a laboratórios públicos para detecção de Covid-19 em pessoas com suspeita de infecção pelo novo coronavírus.
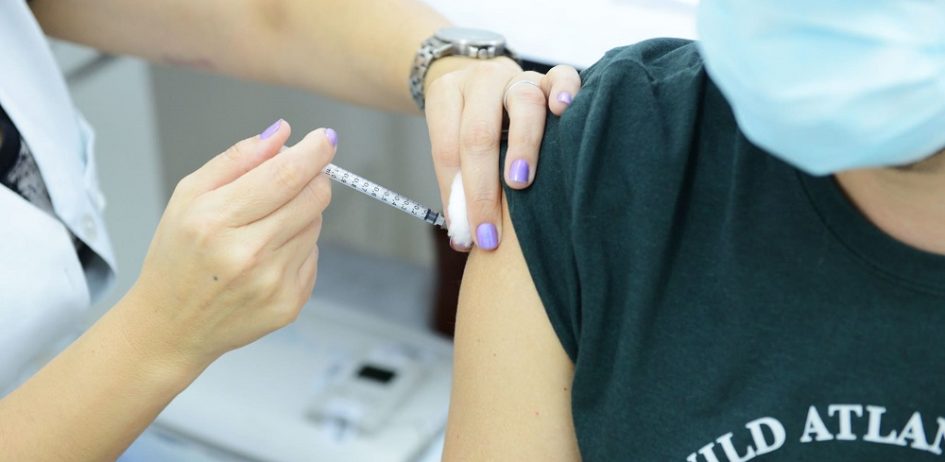
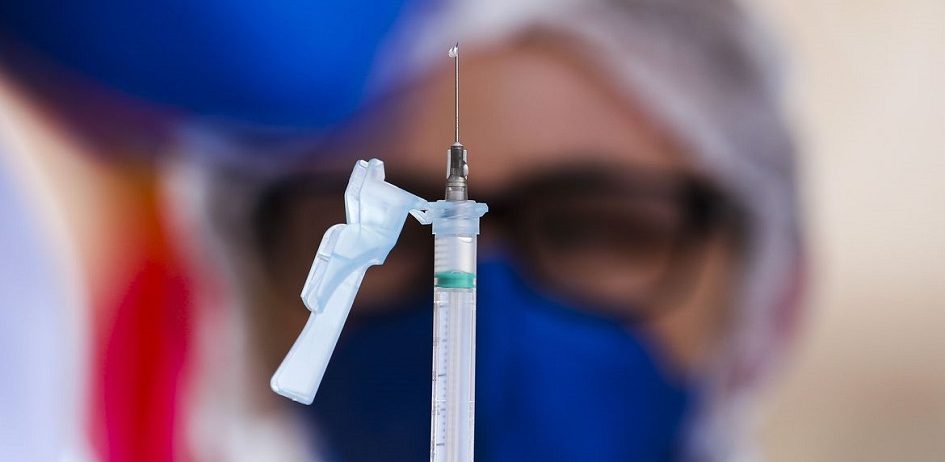
Um lote de testes com pedido de registro indeferido pela Agência Nacional de Vigilância Sanitária – Anvisa foi enviado ao Ministério da Saúde e distribuído a laboratórios públicos para detecção de Covid-19 em pessoas com suspeita de infecção pelo novo coronavírus. A Anvisa indeferiu o pedido de registro em 9 de julho, dois meses depois de o fabricante entrar com a solicitação no órgão. Mesmo assim, os testes foram enviados a laboratórios centrais de saúde pública – Lacens. Ao todo, o Ministério distribuiu 1,93 milhão desses testes.
O teste “Biomol Onestep/Covid-19” é do tipo molecular, o RT-PCR, que detecta partículas do vírus no organismo, a partir da coleta com um cotonete inserido na narina. A produção em massa coube ao Instituto de Biologia Molecular do Paraná – IBMP, a partir de um contrato assinado com a Fundação Oswaldo Cruz – Fiocruz, no valor de R$ 208 milhões. Ao todo, o instituto alega ter produzido 2,2 milhões de testes.
De acordo com a Fiocruz, o pedido de produção partiu do Ministério da Saúde. O material do IBMP equivale a um terço de todos os testes RT-PCR fornecidos pela pasta até agora: 6,4 milhões. Os testes rápidos, que detectam anticorpos, somam oito milhões.
Os órgãos envolvidos e procurados pelo jornal O Globo – IBMP, Fiocruz e Ministério da Saúde – afirmaram que o teste é seguro e eficaz. A Anvisa disse não ter recebido até agora nenhuma denúncia de “comercialização irregular” do produto. “Diante de qualquer comunicação, abriremos dossiê de investigação para apurar os fatos”, afirmou, por meio da assessoria de imprensa.
De forma genérica, a Agência disse que “alguns produtos” estão autorizados a serem utilizados sem registro, “no contexto das excepcionalidades da pandemia”. E citou a necessidade de estarem de acordo com uma lei e uma resolução do órgão que tratam basicamente de regras diferenciadas para importação de produtos.
Por sua vez, o IBMP disse que a causa do indeferimento foram “questões relativas ao modelo de fornecimento de matérias-primas, por alguns insumos estarem fracionados”. “O IBMP está interagindo com a Anvisa, explicando as iniciativas frente à necessidade de atender uma capacidade de produção não previamente esperada à época.” O Ministério da Saúde deu respostas na mesma linha: “O Ministério da Saúde informa que os testes distribuídos aos estados são seguros, de alta qualidade e utilizados dentro das normas”.